|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
СПИРТОВЫЕ ДРОЖЖИ Спиртовые дрожжи в промышленном производстве спирта Атлас производственных дрожжей Saccharomyces cerevisiae расы XII Дрожжегенерирование при непрерывном сбраживании осахаренных заторов Фотостимуляция жизнедеятельности дрожжей для сбраживания пивного сусла Накопление дрожжами целевого продукта - этилового спирта Теоретические основы непрерывного культивирования дрожжей и спиртового производства
СБРАЖИВАНИЕ Контроль качества зрелой бражки Периодический метод сбраживания осахаренного сусла Непрерывные схемы брожения в технологии спирта. Поточный метод сбраживания крахмалистых материалов Расчет бродильного отделения при непрерывном сбраживании затора Головной чан бродильной батареи Брожение и образование сивушного масла Чистка и дезинфекция оборудования спиртового производства Расчет внутреннего змеевикового охладителя бродильного чана Охлаждение бродильного чана выносными теплообменниками Схемы непрерывных бродильных установок с элементами под вакуумом Ускорение непрерывного спиртового брожения рециркуляцией дрожжей Интенсификация непрерывного брожения сусла / бражки с применением вакуума Влияние концентрации сухих веществ в исходном сусле на динамику накопления продуктов брожения Теория непрерывного процесса перемещения жидкости в батарее сообщающихся сосудов Оборудование для непрерывного брожения Влияние адаптации дрожжей к пониженному рН среды на их метаболизм при сбраживании мелассного сусла Сбраживание сусла из крахмалсодержащего сырья термотолерантными дрожжами
|
Атлас производственных спиртовых дрожжей Saccharomyces cerevisiae расы XII (для работников спиртовых заводов перерабатывающих зерно)
Атлас производственных спиртовых дрожжей Saccharomyces cerevisiae расы XII может служить справочным пособием для работников спиртовых заводов, обеспечивающих микробиологический контроль производства. В настоящее время при промышленном производстве продуктов питания с использованием дрожжей применяют, в основном, дрожжи вида Saccharomyces cerevisiae. При производстве хлеба, спирта, вина, хлебного кваса используют различные штаммы (расы) дрожжей. Даже сырье спиртовых заводов (зерно или меласса) влияет на выбор того или иного штамма. При производстве спирта из зерна чаще применяют дрожжи XII расы, постоянным местом обитания которых являются искусственно приготовляемые гидролизованные крахмалистые субстраты. Ведение технологии требует внимательного наблюдения за состоянием дрожжей и наличием посторонних микроорганизмов по участкам производства. Существующие методики позволяют проводить необходимый микроскопический анализ, но без определенной практики сложно идентифицировать полученные данные микроскопического анализа и регламентных показателей технологии. Как известно, именно дрожжи превращают вещества зерна в этиловый спирт, и их можно рассматривать как одно из многочисленных орудий труда человека, а дрожжевую ферментацию - один из самых древних микробиологических процессов, используемых человеком в своих целях. Первое упоминание о применении дрожжей человеком относится к 6000 г. до нашей эры. Научное изучение дрожжей началось в 1680 г. после изобретения светового микроскопа. Исследователи различных стран описали внешний вид дрожжевых клеток; показали, что дрожжи - это живые организмы; доказали их роль при превращении сахара в спирт; получили чистые культуры дрожжей; классифицировали дрожжевые клетки по способу размножения, потреблению питательных веществ и внешнему виду. Современные оптические микроскопы оснащены сухими и иммерсионными объективами. Оптический микроскоп с сухим объективом позволяет изучать микроорганизмы размером более 5 мкм, иммерсионный микроскоп применяют при исследовании более мелких микроорганизмов. Изобретение электронного микроскопа позволило понять структуру дрожжевой клетки и изучить проявления её генетической системы, поскольку разрешающая способность электронного микроскопа 1,0-0,14 нм. Микроскоп - незаменимый прибор при производстве спирта и без него невозможно эффективное ведение технологии: с его помощью определяют количество дрожжевых клеток в 1 мл дрожжевой или бродящей массы; процентное количество почкующихся и мертвых клеток; наличие посторонних микроорганизмов; содержание гликогена в клетках (упитанность клеток). Физиологическое состояние дрожжей устанавливают по внешнему виду клеток, что позволяет использовать дешевые световые микроскопы с сухими объективами. Следует отметить, что современное производство спирта не требует микроскопического анализа структуры дрожжевых клеток, однако при изучении внешнего вида клетки под световым микроскопом необходимо иметь представление и ее строении.
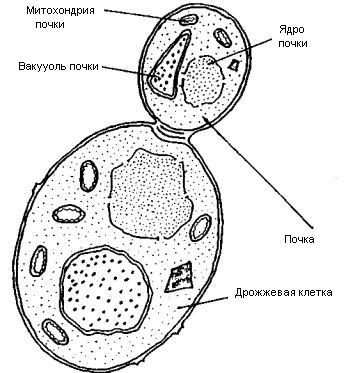
Строение дрожжевой клетки
Дрожжевые клетки имеют округлую или эллипсовидную форму с размером в поперечнике от 2,5 до 10 мкм и от 4,5 до 21 мкм в длину. На рис. 1 приведено графическое изображение среза дрожжевой клетки. Клеточная стенка, клеточная мембрана, ядро, митохондрии, вакуоли - структуры клетки, видимые в световой микроскоп с сухим объективом при использовании специфических красителей. Клеточная стенка представляет собой жесткую структуру толщиной 25 нм, составляет около 25% сухой массы клетки и состоит в основном из глюкана, манана, хитина и белка. Организация клеточной стенки недостаточно изучена, однако современные теории отдают предпочтение модели трехслойной структуры, согласно которой внутренний глюкановый слои отделен от внешнего мананового промежуточным слоем с повышенным содержанием белка. Клеточная мембрана (плазмалемма) дрожжевой клетки под электронным микроскопом выглядит как трехслойная структура, тесно прилегающая к внутренней поверхности клеточной стенки, и состоит примерно из равного количества липидов и белков, а также небольшого количества углеводов. Клеточная мембрана выполняет роль барьера проницаемости вокруг содержимого клетки и контролирует транспорт растворенных веществ внутрь клетки и из нее. В изучении ядра достигнуты лишь некоторые успехи, поскольку индивидуальные хромосомы очень малы и не выявляются в виде дискретных структур ни в световом, ни в электронном микроскопах. Дрожжевые клетки имеют одно ядро размером от 2 до 20 мкм. Ядерная мембрана остается неизменной на протяжении всего клеточного цикла. Под электронным микроскопом она выглядит как двойная мембрана, усеянная порами. Митохондрии - самые большие из клеточных включений сферической или цилиндрической формы размером в поперечнике от 0,2 до 2 мкм и от 0,5 до 7 мкм в длину. Двухслойная оболочка имеет толщину около 20 нм. Количество митохондрий в клетке более или менее постоянно и характерно для данного вида микроорганизмов.
Рис. 1. Графическое изображение среза дрожжевой клетки (в 1 сантиметре 1 микрометр)
Оно меняется в зависимости от стадии развития клетки и функциональной активности от 500 до 2000 тт. Функции митохондрий связаны с переносом электронов, ионов, субстратов внутри клетки. Помимо этого в митохондриях синтезируются вещества, аккумулирующие химическую энергию клетки. Зрелые дрожжевые клетки содержат большую вакуоль. При образовании почки вакуоль, по всей вероятности, дробится на более мелкие вакуоли, которые распределяются между материнской клеткой и почкой. В дальнейшем эти маленькие вакуоли снова сливаются, образуя по одной вакуоли в материнской и дочерней клетках. Функция вакуоли точно не установлена. В ней содержатся гидролитические ферменты, полифосфаты, липиды, ионы металлов и др. Вакуоль, возможно, выполняет функции резервуара для хранения питательных веществ и гидролитических ферментов. Внутриклеточное содержимое дрожжевой клетки (за исключением ядра, митохондрий и вакуоли), как известно, называют цитоплазмой, состоящей из воды, липидов, углеводов, различных высокомолекулярных и низкомолекулярных соединений, минеральных солей и др. Исследование клетки под электронным микроскопом показало сложную структуру цитоплазмы в виде гранул, функции и химические свойства которых достаточной мало не изучены. Цитоплазма играет важную роль в биохимии клетки и находится в тесном взаимодействии с органеллами, которые она окружает. Отличительная особенность популяции растущих дрожжевых клеток - наличие почек, образующихся при делении клеток. Дочерняя клетка возникает в виде маленькой почки, которая растет в течении большей части клеточного цикла. Рост дрожжей происходит в основном во время формирования почек, поэтому почка к моменту её отделения становится по размеру более или менее такой же, как зрелая клетка (см. рис. 2). Клетки могут разойтись вскоре после деления, однако часто ещё до их расхождения начинаются новые циклы клеточного деления, в результате чего образуются группы клеток. На месте отделения клеток друг от друга остаются следы, называемые у материнской клетки дочерним шрамом, а у дочерней клетки - родовым шрамом. На одном и том же месте клеточной стенки никогда не появляются две почки. Каждый раз почка оставляет новый дочерний шрам на стенке материнской клетки. По числу шрамов можно определить, сколько почек образовала данная клетка, что позволяет оценить возраст клетки. Установлено, что у гаплоидных клеток насчитывается максимально 18, а диплоидных - 32 почечных шрама.
Рис. 2. Графическое изображение почкующейся клетки.
Методы световой микроскопии и микробиологического контроля, используемые в технологии спирта. В технологии спирта при проведении микроскопического анализа популяции дрожжей световым микроскопом с сухим объективом рассматривают внешний вид клеток методом раздавленной капли в неокрашенном или окрашенном видах (прижизненные препараты), производят подсчет общего количества клеток и процентного количества почкующихся клеток, определяют наличие посторонних микроорганизмов. Метод раздавленной каплиНа предметное стекло наносят каплю исследуемой взвеси с дрожжевыми клетками, которую сверху накрывают покровным стеклом. Полученный образец рассматривают под микроскопом, где микроорганизмы видны в различных плоскостях. Данный метод прост, его применяют при изучении подвижности и внутреннего строения клеток микроорганизмов. Метод раздавленной капли без использования красителей позволяет различать дрожжевые клетки по толщине клеточных стенки и мембраны, состоянию цитоплазмы, наличию или отсутствию вакуолей, процентному количеству почкующихся и мертвых клеток, присутствию молочнокислых бактерий. Подсчет процентного количества почкующихся клеток
Для определения количества почкующихся клеток на предметное стекло наносят по одной капле дрожжевой суспензии без твердых включений и дистиллированной воды, закрывают покровным стеклом, излишек жидкости отбирают листком фильтровальной бумаги и микроскопируют. У зрелых дрожжей почкуется более 10% клеток. Пример. Всего в 5 полях зрения обнаружено 33+35+29+32+30=159 дрожжевых клеток, в т. ч. почкующихся 4+5+3+5+3=20. Процентное количество почкующихся клеток составляет 20 х 100/159 = 12,5 (%).
Измерение величин микроорганизмов
Единицей измерения величины микроорганизмов служит микрон (мкм), равный 0,001 миллиметра (мм). При измерении пользуются окуляр-микрометром - круглым стеклом с нанесенной на него шкалой (каждый миллиметр шкалы разделен на 10 делений). Стекло накладывают на диафрагму окуляра так, чтобы сторона с делениями оказалась вверху. Для тарирования значений одного деления окуляр-микрометра используют объект-микрометр, который помещают на столик микроскопа и рассматривают как препарат. Объект-микрометр представляет собой стеклянную пластинку со шкалой, одно деление которой равно 0,01 мм (или 10 мкм). На рис. 3 показано поле зрения микроскопа со шкалами окуляр-микрометра и объект микрометра. По совпадению делений обоих шкал устанавливают масштабный коэффициент для определения истинного значения одного деления окуляр-микрометра. На рисунке с делениями объект-микрометра совпали деления окуляр-микрометра №2 и №8, или 30 делений окуляр-микрометра совпали с 5 делениями объект микрометра (составляющими 50 мкм). Таким образом, одно деление окуляр-микрометра примерно равно 1,67 мкм (50/ 30=1,666...). Если вместо объект-микрометра на столик микроскопа поместить препарат с живыми дрожжами, можно определить их видимые размеры (длину и ширину), рассматривая препарат в те же объектив и окуляр и с тем же выдвижением тубуса. Для этого необходимо установить, какому числу окулярных делений соответствует величина измеряемого объекта, и затем это число умножить на полученное значение масштабного коэффициента (в нашем случае равным 1,67 мкм). Полученные результаты измерений не поддаются математической обработке в соответствии с теорией эксперимента, однако они дают представление о размерах изучаемых микроорганизмов.
Подсчет количества клеток
Для подсчета количества дрожжевых клеток пользуется счетной камерой Горяева представляющей собой толстое предметное стекло с нанесенными на него поперечными прорезями. которые образуют три поперечно расположенные
Рис. 3. Шкалы объект-микрометра и объектив микрометра для измерения величин микроорганизмов под микроскопом площадки. Средняя из них разделена на две части, на каждой из которых выгравирована сетка (см. рис. 5) площадью 9 мм2, разделенная на 225 больших квадратов площадью 0,04 мм2 каждый (15 рядов по 15 квадратов) и 400 малых квадратов площадью 0,0025 мм2 каждый (каждый третий ряд больших квадратов в горизонтальном и вертикальном направлении разделен на 16 малых квадратов). Средняя площадка предметного стекла опущена на 0,1 мм относительно двух других площадок, на которые накладывают специальное шлифованное покровное стекло размером 18x18 мм, что обеспечивает создание камеры для дрожжевой суспензии. Количество клеток определяют в соответствии с формулой О = А х К1 х К2 х В, где В количество клеток в 1 мл суспензии, шт/мл; А количество клеток в 80 малых квадратах, шт.; К., коэффициент глубины камеры (при глубине камеры 0.1 мм
Рис. 4. Камера Горяева: 1 - предметное стекло; 2 - специальное покровное стекло; 3 - камера для дрожжевой суспензии; 4, 6 - площадка для покровного стекла; 5 - сетка для подсчета дрожжевых клеток; 7 - прорезь для введения дрожжевой суспензии К1 = 10; при глубине камеры 0,2 мм К1 = 5); К2 -коэффициент пересчета объема, 1/мл (К2 = 5000 1/ мл); В - коэффициент разбавления пробы (для дрожжей В=10). При подсчете дрожжевых клеток в камере Горяева с глубиной 0,1 мм и десятикратным разбавлением дрожжевой суспензии В = 5 х 104А х В. В зрелых дрожжах и сбраживаемом сусле (во время главного брожения) количество дрожжевых клеток превышает 80 млн шт/мл. Подсчет процентного количества мёртвых клеток в дрожжевой суспензии Для определения количества мёртвых клеток на предметное стекло наносят по одной капле не фильтрованной дрожжевой суспензии и раствора метиленовой сини (1:5000), окрашивающей мертвые клетки в синий цвет. Каплю закрывают покровным стеклом, излишек жидкости собирают листком фильтровальной бумаги и через 2 мин микроскопируют. В поле зрения микроскопа считают общее количество дрожжевых клеток, затем только синие, после чего препарат передвигают и подсчет ведут в новом поле зрения. Таким образом подсчитывают общее количество клеток в пяти полях зрения. После подсчета вычисляют количество мертвых клеток в процентах. В зрелых дрожжах количество мёртвых клеток не должно превышать 1%. Пример. Всего в пяти полях зрения обнаружено 43+45+39+42-40=209 дрожжевых клеток, в т. ч. окрашенных в синий цвет 1 +0+0+0+1=2. Процентное количество мёртвых клеток составляет 2 х 100/209 = 0,96 (%).
Рис. 5. Сетка для подсчета дрожжевых клеток в камере Горяева: 1 - большой квадрат; 2 - малый квадрат
Определение содержания гликогена в дрожжевых клетках
При нормальной технологии в дрожжах накапливается гликоген, когда 2/3 сахара сусла сброжены и дрожжи пригодны для использования в производстве. Для определения количества гликогена в дрожжевых клетках на предметное стекло наносят каплю нефильтрованной дрожжевой суспензии и 2 капли 0,5%-ного раствора йода (0,5 г йода и 1 г KJ на 100 мл воды), капли смешивают, накрывают покровным стеклом, отбирают излишек жидкости листком фильтровальной бумаги и микроскопируют. При соотношении дрожжевой суспензии и раствора йода 1:2 через 2-3 мин клетки окрашиваются в светло-желтый цвет, а гликоген - в коричневый. Применять более крепкий раствор йода, чем 1%-ный, нельзя, так как он окрашивает в коричневый цвет не только гликоген, но и всю клетку. У зрелых дрожжей гликоген занимает от 1/3 до 2/3 клеток.
Определение бактериальной инфекции
Для определения процентного содержания бактериальной инфекции (в первую очередь молочнокислых бактерий) из пробы дрожжей берут одну каплю дрожжевой суспензии без твердых включений и помещают ее на предметное стекло, куда добавляют одну каплю дистиллированной воды. Обе капли смешивают и накрывают предметным стеклом, удаляя излишек жидкости листком фильтровальной бумаги, и микроскопируют. Поскольку производственные дрожжи ведут в нестерильных условиях по методу естественно чистой культуры, то в них всегда можно обнаружить некоторое количество бактерий. При нормальной технологии в сернокислых дрожжах в поле зрения микроскопа (с объективом х40 и окуляром х7 и более) находят от 1 до 3 клеток бактерий, среди которых обычно не бывает подвижных форм. Наличие в поле зрения микроскопа большего количества бактерий говорит о нарастании кислотности в производственных дрожжах или в сбраживаемом сусле. Спороносные подвижные формы бактерий при закисании дрожжевого затора обычно не развиваются вследствие накопления этилового спирта.
Внешний вид дрожжевых клеток
Покоящиеся дрожжи чистой культуры, молодые, зрелые, старые, голодающие и мертвые клетки можно определить по их размерам и форме, строению и внутреннему содержимому.
Размер и форма дрожжевых клеток
В среднем размеры клеток дрожжей расы XII составляют 6x9 мкм, однако в зависимости от условий среды, возраста и условий развития (кислотность, доступ кислорода и т.п.), их фактические размеры имеют отклонения в большую и меньшую стороны. Формы дрожжей одной расы определяются, в основном, условиями развития. Клетки имеют овальную форму при культивировании на зерновом сусле; при росте на твердой среде все расы дрожжей дают более или менее вытянутые клетки; несколько удлиненную форму имеют также дрожжи в момент интенсивного развития.
Строение и внутреннее содержимое клетки
При микроскопическом анализе дрожжевых клеток следует обращать внимание на толщину оболочек; вид цитоплазмы; наличие в клетки вакуолей и гликогена; количество в популяции мёртвых клеток. У молодых клеток толщина оболочки мало заметна, а у старых выступает в виде хорошо видимого ободка, который при дальнейшем старении становится двуконтурным. Вид цитоплазмы может быть однородный или зернистый. Зернистость большей частью характерна для старых, больных и развивавшихся в ненормальных условиях (высокая температура или перемена температур, высокая кислотность, инфекция) клетках. Отставание цитоплазмы от оболочки клетки бывает при плазмолизе или свидетельствует о разрушении клетки. Количество гликогена в дрожжах непостоянно и зависит от их возраста. Наибольшее количество гликогена накапливается у зрелых дрожжей.
Вид дрожжевых клеток под объективом микроскопа в зависимости от их возраста
Вид дрожжевых клеток в зависимости от возраста
У молодых дрожжей оболочка очень тонкая, цитоплазма нежная и однородная. Вакуолей нет или видны малые вакуоли у небольшого количества клеток. Гликоген в единичных клетках. Зрелые дрожжи имеют четко очерченные оболочки. Заметно 10-15% клеток с почками. В цитоплазме видна неоднородность, зернистость, появляются средние по величине вакуоли, в клетках содержится много гликогена. Количество мёртвых клеток не превышает 1%. У перезрелых дрожжей отчетливо видна толстая оболочка при сильной зернистости цитоплазмы. Большие вакуоли занимают почти всю клетку. Если дрожжам не хватало питательных веществ, то клетки уменьшаются в размерах. Почкуются единичные клетки. Процент мёртвых клеток по мере старения прогрессивно увеличивается. Оболочки голодающих дрожжей толстые (у некоторых клеток оболочки имеют переменную толщину), их содержимое зернисто. Клетки уменьшаются в размерах, съёживаются, немного удлиняются. Вакуоли отсутствуют, гликогена нет. Отмирание и разрушение дрожжей происходит в несколько стадий. Цитоплазма становится комковатой, но прилегает к хорошо видимой оболочке. Затем оболочка расплывается и распадается. Протоплазма становится ещё более зернистой и распадается на мелкие части. Иногда оболочка остаётся, но протоплазма отстаёт от неё, собирается комком в центре, клетка удлиняется, принимает неправильную форму и разрушается. В таблице приведены данные о внешнем виде дрожжевых клеток в зависимости от их возраста.
Внешний вид дрожжевых клеток при дрожжегенерации
При пуске завода (при освоении производства, в начале сезона или при инфицировании оборудования) дрожжи готовят из чистой культуры, поступающей на завод в пробирке. Разведение чистой культуры производят путем последовательного переноса клеток из пробирки в колбу емкостью 500 мл, затем в пятилитровую бутыль и маточник, откуда дрожжи поступают в дрожжанку, где приготавливают производственные дрожжи. Чистая культура дрожжейНа рис. 6 приведено изображение поля зрения микроскопа с дрожжевыми клетками, перенесенными из пробирки с чистой культурой в колбу с суслом. Оболочки клеток очень тонкие, цитоплазма нежная и однородная, вакуолей нет. В поле зрения микроскопа нет молочнокислых бактерий, что говорит о хорошем качестве чистой культуры дрожжей. На рис. 7 дрожжи из колбы 500 мл после 24 ч роста. Тонкие оболочки, однородная цитоплазма клеток и отсутствие в ней вакуолей говорят о молодости дрожжей. Отсутствие молочнокислых бактерий в поле зрения микроскопа и большое количество делящихся клеток (более 15%) ещё раз подтверждают хорошее качество чистой культуры. Производственные дрожжи Качество дрожжей перед передачей их в производство определяют по количеству почкующихся клеток, наличию в дрожжах молочнокислых бактерий, количеству мёртвых клеток, упитанности дрожжей (количество гликогена в клетках), количеству клеток в 1 мл дрожжей. На рис. 8-11 приведены изображения полей зрения микроскопа с пробами зрелых дрожжей из одной дрожжанки при определении их качества перед передачей в производство. На всех изображениях крупные клетки овальной формы с четко очерченными оболочками и зернистой цитоплазмой. Почкуется более 10% клеток, а в поле зрения микроскопа не более 3 клеток молочнокислых бактерий (см. рис. 8). Количество мёртвых клеток не превышает 1% (см. рис. 9). Содержание гликогена говорит об упитанности дрожжей (см. рис. 10). Количество дрожжевых клеток составляет 120 млн. шт./мл (см. рис.-11). На основании проведенного анализа можно сделать только один вывод: дрожжи в дрожжанке хорошего качества и их можно передавать в производство. В некоторых случаях происходит инфицирование дрожжей, в первую очередь молочнокислыми бактериями. На рис. 12 приведено изображение поля зрения микроскопа с пробами зрелых инфицированных дрожжей. Крупные клетки овальной формы с четко очерченными оболочками и зернистой цитоплазмой. Почкуется значительное количество клеток, однако в поле зрения микроскопа больше 3 клеток молочно кислых бактерий. Подобные дрожжи не пригодны для использования в производстве. При остановке спиртовых заводов (отсутствие сбыта готовой продукции или капитальный ремонт) дрожжи хранятся при температуре 10...12°С в течение нескольких месяцев. На рис. 13 приведено изображение поля зрения микроскопа с пробой захоложенных дрожжей из дрожжанки, которые хранились при температуре 7... 10 °С в течение 45 сут. Дрожжевые клетки различаются по размерам и форме. Одни клетки имеют овальную форму и гонкие оболочки с однородной цитоплазмой, как молодые или зрелые клетки. Другие клетки потеряли форму, оболочки толстые переменной толщины, цитоплазма сильно зернистая, что позволяет отнести их к голодающим и перезрелым клеткам. Захоложенные дрожжи применяют в производстве. На рис. 14 приведено изображение поля зрения микроскопа с пробой зрелых дрожжей из дрожжанки, при выращивании которых использовали захоложенные дрожжи. Клетки крупные, овальной формы, с четко очерченными оболочками и зернистой цитоплазмой. Некоторые клетки почкуются, количество клеток молочнокислых бактерий не превышает нормы. Две клетки имеют разрушенные оболочки. По всей вероятности, это остатки клеток захоложенных дрожжей. Дрожжи пригодны для использования в производстве.
Рис. 6. Чистая культура
дрожжей
Рис. 7. Чистая культура дрожжей спустя 1 сутки
Рис. 8. Зрелые дрожжи из дрожжанки
Рис. 9. Зрелые дрожжи (подсчет процентного количества мертвых клеток)
Рис. 10. Зрелые дрожжи (определение упитанности дрожжей)
Рис. 11. Зрелые дрожжи (подсчет количество клеток в одном миллилитре дрожжей)
Рис. 12. Зрелые инфицированные дрожжи
Рис. 13. Зрелые дрожжи из дрожжанки после 45-суточного хранения при температуре 7.. .12 °С
Рис. 14. Зрелые дрожжи из дрожжанки, выращенные из захоложенных дрожжей
Внешний вид дрожжевых клеток при сбраживании сусла При сбраживании сусла проведение микроскопического анализа целесообразно в случае нарастания титруемой кислотности бражки при брожении более чем на 0,2 °К (закисании бражки). На рис. 15 приведено изображения поля зрения микроскопа с пробой из закисшего бродильного чана (периодическая схема сбраживания сусла, 72 ч брожения). Поскольку сбраживание сусла окончено, то анализ внешнего вида и внутреннего содержимого дрожжевых клеток не дает результата. Большое количество молочнокислых бактерий в поле зрения микроскопа говорит о бактериальном закисании бродильного чана.
Рис. 15. Инфицированная бражка из бродильного чана
Рекомендации по использованию микроскопического анализа при производстве спирта из зерна
В настоящее время спиртовые заводы применяют несколько технологических схем производства спирта из зерна, отличающихся температурой тепловой обработки сырья: с использованием аппаратов типа «Генц» - до 165 °С; агрегатов непрерывного разваривания (Мичуринская схема) - до 150 °С; аппаратов гидродинамической обработки замеса - до 95 °С. Помимо этого спиртовые заводы применяют различные осахаривающие материалы: солод; неочищенные ферментные препараты, получаемые в условиях спиртового завода; очищенные ферментные препараты, производимые специализированными биохимическими заводами. Способы тепловой обработки замеса и используемые ферментные препараты влияют на все технологические показатели, в т. ч. на показатели приготовления дрожжей и сбраживания сусла. В атласе даны рекомендации по использованию микроскопического анализа при производстве спирта из зерна с применением аппаратов гидродинамической обработки замеса, очищенных ферментных препаратов и сернокислых дрожжей. Инфицирование чистой культуры дрожжей Микроскопический анализ пробы дрожжей из пробирки с чистой культурой или колбы после 20 ч роста показал наличие в полях зрения микроскопа молочнокислых бактерий. Чистая культура дрожжей инфицирована (как правило, это происходит при длительном хранении в условиях высоких температур). Необходимо поменять чистую культуру дрожжей. При повторном выявлении инфекции в чистой культуре целесообразно поменять поставщика чистой культуры дрожжей. Инфицирование производственных дрожжей Микроскопический анализ пробы зрелых дрожжей из дрожжанки показал наличие в поле зрения микроскопа более 3 клеток молочнокислых бактерий, что говорит об инфицировании зрелых дрожжей. Инфицирование дрожжей происходит в результате следующих основных причин: использование некачественного зерна; применение воды из открытых водоемов (особенно в теплое время года); использование некачественных ферментных препаратов; некачественная мойка и стерилизация оборудования и трубопроводов; нарушения регламентных показателей приготовления дрожжей; эксплуатация устаревшего оборудования на заводе. В себестоимости спирта стоимость зерна занимает 40-60% и использование дешевого зерна улучшает экономические показатели производства. Однако при применении некачественного сырья возникают потери спирта в результате инфицирования. Целесообразно использовать зерно с качеством не ниже первой степени дефектности: зерно, вышедшее из стадии покоя; проявляющее усиленные физиологические процессы (дыхание), способствующие жизнедеятельности микроорганизмов; имеющее солодовый или гнилистый запахи, однако пригодное для производства. При необходимости переработки некачественного зерна температуру тепловой обработки замеса следует повысить до 130...135 °С. При применении воды из открытых водоемов в теплое время года температуру тепловой обработки замеса можно повысить до 130...135 °С. Предпочтительно использовать воду питьевого качества из водопровода или артезианской скважины. Целесообразно применять способы обеззараживания воды или замеса путем их обработки магнитными и другими излучениями, используемыми в пищевой и медицинской промышленностях при обработке продуктов питания и медицинской техники. Если не удается найти источник инфицирования зрелых дрожжей, то проверяют ферментные препараты на их бактериальную зараженность. В первую очередь инфицированными оказываются ферменты. производимые в условиях спиртовых заводов и неочищенные (в жидком виде) транспортируемые автомобильным или железнодорожным транспортом (особенно в жаркое время года). При инфицировании ферментных препаратов их заменяют на качественные и меняют поставщика ферментов. Мойку оборудования при дрожжегенерации осуществляют щетками и водой из шлангов (давление 3-4 кг/см2) с последующей стерилизацией паром. Расход пара составляет 10-12 кг на 1 м дрожжанки при 30-минутном пропаривании. Мойку трубопроводов проводят различными моечными растворами с последующей стерилизацией паром. Наиболее сложные для мойки и стерилизации внутренние змеевики. Змеевики охлаждения дрожжанок целесообразно заменить на рубашки охлаждения, а мойку внутренней поверхности проводить теплой водой поддавление 120-150 кт/см: с использованием очистителей высокого давления. Наибольший эффект от применения подобных очистителей достигается при мойке сварных стыковых и угловых швов внутри оборудования, а также при мойке внутренней поверхности дрожжанок с коррозионными раковинами. Использование очистителей позволяет уменьшить расход пара и моющих растворов, а также исключить ручной труд при мойке внутренних поверхностей оборудования щетками. Мойку и стерилизацию трубопроводов осуществляют в соответствии с регламентом. Наиболее затруднительны мойка и стерилизация теплообменников типа «труба в трубе», охлаждающих осахаренную массу с 52...60 °С (в зависимости от используемых ферментов) до 22...28 °С (в зависимости от применяемых дрожжей), особенно если часто происходит остановка насосов, перекачивающих замес в осахариватель, что приводит к задержке массы в теплообменнике. Теплообменник типа «труба в трубе» целесообразно заменить на пластинчатый теплообменник, который в десятки раз меньше по габаритам, изготовлен из нержавеющей стали и его легко мыть в разобранном состоянии и стерилизовать. При приготовлении дрожжей необходимо придерживаться показателей технологического регламента. Наиболее трудно обеспечить подачу в змеевики дрожжанок достаточного количества воды (особенно в теплое время года) и без задержек передавать зрелые дрожжи в бродильный чан. Замена охлаждающих змеевиков на рубашку охлаждения позволяет в несколько раз увеличить поверхность охлаждения дрожжанки и при нехватке холодной воды достичь охлаждения дрожжевой массы до необходимой температуры. Имея значительную поверхность охлаждения в дрожжанках можно добиться своевременной подачи дрожжей в бродильный чан за счет изменения температуры дрожжегенерации. Снижение температуры дрожжегенерации до 25...27 °С обеспечивает увеличение сроков приготовления дрожжей, а увеличение температуры дрожжегенерации до 30...32 °С ускоряет приготовление дрожжей. В технологии спирта емкостное оборудование, как правило, изготавливают из черной стали с толщиной стенок 5-8 мм. Большая толщина стенок позволяет использовать дрожжанки и трубопроводы до 25 лет без ремонта. За это длительное время на стенках дрожжанок по различным причинам образуются раковины (коррозия металла, кавитационные процессы в жидкости, усталость металла), которые плохо отмываются и способствуют инфицированию зрелых дрожжей. Необходимо вовремя менять оборудование (один раз в 6-7 лет эксплуатации) и, тем самым, исключать очаги инфицирования дрожжей. Недостаточная упитанность дрожжевых клеток Микроскопический анализ пробы зрелых дрожжей из дрожжанки показал, что гликоген в клетках занимает менее 1/4 внутреннего содержимого, а клетки дрожжей уменьшились в размерах. Указанное говорит о том, что дрожжи или не дозрели и их рано передавать в производство или они перестояли и клеткам необходимо дополнительное питание. В первом случае достаточно увеличить время дрожжегенерации. Во втором целесообразно проверить продолжительность гидродинамической обработки зернового замеса (полноту заполнения аппарата гидродинамической обработки замеса в соответствии с регламентом), от чего зависит количество растворимых сухих веществ сырья и, в особенности, растворение белков зерна, поскольку недостаток азотистого питания снижает бродильную активность дрожжей; правильность дозирования ферментов в осахаривателе. При недостатке азотистого питания можно, использовать карбомид, который учитывается и дозируется, исходя из содержания в нем азота. Повышенное количество мертвых клеток Микроскопический анализ пробы зрелых дрожжей выявил, что содержание мёртвых клеток превышает 1% от общего числа дрожжей. Сверхнормативное отмирание дрожжевых клеток происходит при повышении температуры во время дрожжегенерации выше регламентной (30 °С) или при повышении кислотности дрожжевого сусла (выше 1,1 °К). Целесообразно проконтролировать выполнение регламентных показателей дрожжегенерации. Уменьшенное количество клеток в 1 мл дрожжей и недостаточное количество почкующихся клеток Подсчет количества дрожжевых клеток под микроскопом показал, что их содержание в дрожжах 80 млн шт/мл, а подсчет количества почкующихся клеток выявил, что в поле зрения микроскопа менее 10% почкующихся дрожжей. Необходимо проверить выполнение всех регламентных показателей, качество зерна, ферментов, серной кислоты (определить наличие в ней мышьяка). Следует заменить некачественное сырьё и вспомогательные материалы. Инфицирование сбраживаемого сусла Микроскопический анализ пробы сбраживаемого сусла показал наличие большого количества молочнокислых бактерий. Следует ожидать уменьшение выхода спирта из 1 тонны зерна, поскольку питательные вещества сырья перерабатываются бактериями в молочную кислоту. Причинами инфицирования бражки могут быть: нарушение регламентных показателей при брожении; необоснованное увеличение времени сбраживания сусла, когда количество несброженных углеводов в бражке составляет менее 0,65 г/100 мл (при гидродинамической обработке замеса после 48-60 часов сбраживания), а бражка продолжает выдерживаться в бродильном чану до 72 часов; недостаток охлаждающей воды. При нарушении регламентных показателей сбраживания сусла и необоснованном увеличении времени сбраживания достаточно провести организационные мероприятия, обеспечивающие технологическую дисциплину на предприятии. При недостатке охлаждающей воды необходимо осуществить технические мероприятия. Применение рубашек охлаждения вместо змеевиков позволяет в несколько раз увеличить поверхность охлаждения бродильных чанов, что значительно снижает потребление воды. На заводах, применяющих для охлаждения бражки выносные теплообменники типа «труба в трубе», целесообразно заменить их на пластинчатые теплообменники, что позволит более эффективно охлаждать бражку не изменяя температуру охлаждающей воды. Недостатки охлаждающей воды можно возместить снижением ее температуры, путем внедрения градирен и холодильных установок. ЗАКЛЮЧЕНИЕ При производстве спирта основным компонентом технологии служат дрожжи, требующие большого внимания и ответственного отношения обслуживающего персонала, что возможно только при помощи микроскопического анализа как отдельных клеток, так и дрожжевой популяции в целом. По внешнему виду клеток можно определить физиологическое состояние дрожжей и внести коррективы в технологию. Авторы считают, что приведенные в настоящем атласе изображения дрожжей под микроскопом облегчат работу обслживающего персонала спиртовых заводов при разведении чистой культуры дрожжей, дрожжегенерации и сбраживании сусла.
Литература 1. ГУ 9182-160-00008064-98. Чистая культура дрожжей. Расса XII. 2. Павлович С.А. Медицинская микробиология. -Минск: Вышейшая школа, 1997. 133 с. 3. Яровенко и др. Технология спирта. -М.: Колос, 1996. 464 с. 4. Терновский Н^С. и др. Ресурсосберегающая технология в производстве спирта. -М.: Пищевая промышленность, 1994. 168 с. 5. Сассон А. Биотехнология: свершения и надежды. -М.: Мир, 1987. 411 с. 6. Рухлядева А.П. и др. Инструкция по технохимическому и микробиологическому контролю спиртового производства. -М.: Агропромиздат, 1986. 399с. 7. Бачурин П.Я., Устинников Б.А. Оборудование для производства спирта и спиртопродуктов. -М.: Агропромиздат, 1985. 344 с. 8. Берри Д. Биология дрожжей. -М.: Мир, 1985. 95 с. 9. Коновалов С.А. Биохимия дрожжей. -М.: Пищевая промышленность, 1980. 272 с. 10. Селибер Г.Л. Большой практикум по микробиологии. -М.: Высшая школа, 1962. 420 с.
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||